ニュースリリース
微細藻類ユーグレナのゲノム編集技術を拡張
-より柔軟かつ緻密なゲノム改変が可能に-
理化学研究所
株式会社ユーグレナ
概要
理化学研究所(理研)環境資源科学研究センターバイオ生産情報研究チームの野村俊尚研究員(科技ハブ産連本部バトンゾーン研究推進プログラム藻類資源アップサイクル研究チーム研究員(いずれも研究当時)、現山形大学農学部准教授、環境資源科学研究センターバイオ生産情報研究チーム客員主管研究員)、持田恵一チームリーダー(科技ハブ産連本部バトンゾーン研究推進プログラム藻類資源アップサイクル研究チーム副チームリーダー)、科技ハブ産連本部バトンゾーン研究推進プログラム藻類資源アップサイクル研究チームの鈴木健吾チームリーダー(株式会社ユーグレナエグゼクティブフェロー)らの共同研究グループは、微細藻類ユーグレナの産業利用種であるユーグレナ・グラシリス(Euglena gracilis)[1](以下、ユーグレナ)において、Cas12a RNP複合体[2]を用いた高効率ゲノム編集技術[3]を確立するとともに、1塩基レベルの精密な塩基書き換え[4]に成功しました。
共同研究グループは、すでに確立していたCas9 RNP複合体を用いたゲノム編集技術に加え、標的配列の認識ルールや切断様式が異なるCas12a (Cpf1) RNP複合体を用いた高効率ゲノム編集技術を確立しました。加えて、合成した一本鎖DNAを用いることにより、1塩基レベルでの精密な塩基書き換えが可能であることを実証しました。従来法では難しかったATリッチ領域[2]を標的としたゲノム編集による遺伝子機能解析や、1塩基レベルの書き換えによるタンパク質の精密なエンジリニアリングといったユーグレナの分子育種[5]に貢献すると期待できます。
また、本研究では、産業界との融合的連携研究制度による株式会社ユーグレナと理研との連携チーム(微細藻類生産制御技術研究チーム/藻類資源アップサイクル研究チーム)により、パラミロン(ユーグレナが特異的に蓄積する多糖)の測定において信頼性のあるデータを取得することができ、スムーズな研究成果の獲得につながりました。今後、この連携チームで、本研究成果が産業上有用なユーグレナ株の作出に利用されることが期待されます。
本研究は、科学雑誌『Microbial Biotechnology』オンライン版(2月8日付)に掲載されました※。
※2024年2月14日、論文情報について更新しました
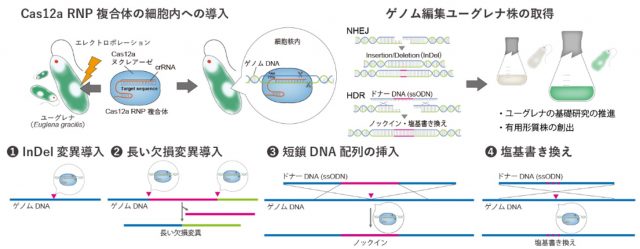
ユーグレナにおけるCas12a RNPを用いたゲノム編集技術の概要
背景
持続可能な開発目標(SDGs)[6]の達成や、持続可能性のある経済活動を目指すバイオエコノミー社会の実現に向け、微細藻類資源を利用したバイオ燃料製造やバイオものづくり技術の開発が求められています。特にユーグレナ・グラシリス(Euglena gracilis、以下ユーグレナ)は、屋内外での大量培養技術が確立されており、健康機能を有しバイオマスプラスチックの材料ともなるパラミロンやバイオ燃料の原料に適した油脂(ワックスエステル)を産生することから、その利活用が推進されています。このような背景から、本種を効率的に育種するための自在なゲノム改変技術の開発が求められています。
先行研究において共同研究グループは、Cas9 RNP複合体を用いたユーグレナの高効率ゲノム編集技術を確立し注1)、この技術を使って、回収が容易になるよう遊泳不全ユーグレナ株の作出や注2)、眼点での光認識に関わるカロテノイド(色素)の同定を進めてきました注3)。
本研究では、本種を対象としたゲノム改変技術を拡張するため、Cas9ヌクレアーゼ(核酸分解酵素)とは異なった性質を有するCas12aヌクレアーゼを用い、かつ緻密にコントロールできるゲノム編集方法の確立を目指しました。
注1)2019年6月17日のプレスリリース「ミドリムシでの高効率ゲノム編集に成功」
https://www.riken.jp/press/2019/20190617_1/
注2)2022年9月9日のプレスリリース「ゲノム編集で遊泳不全ミドリムシの作出に成功」
https://www.riken.jp/press/2022/20220909_1/
注3)2023年1月30日のプレスリリース「ユーグレナの眼点をつかさどる色素を同定」
https://www.riken.jp/press/2023/20230130_2/
研究手法と成果
共同研究グループは、ユーグレナにおいて従来技術では難しかったATリッチなゲノム領域などを対象としたゲノムの編集を可能にするため、Cas12a RNPベースのゲノム編集技術の導入に着手しました。変異導入により、パラミロン粒形成不全となるEgGSL2(パラミロン合成酵素)遺伝子、白色化を引き起こすEgCrtB(フィトエン合成酵素)遺伝子を標的としたCas12a RNP複合体を用い、エレクトロポレーション法[7]による直接導入法を検討しました。
その結果、両標的遺伝子において、対応した表現型の変化を引き起こした変異導入株が取得されました(図1)。ゲノム編集効率を調べるためアンプリコンシークエンス解析[8]を行ったところ、77.2~94.5%の効率でランダムな挿入(Insertion)または欠失(Deletion)の変異(InDel変異)導入が検出され、Cas9 RNP複合体を用いた場合と同程度の高い効率でのゲノム編集が可能でした(図1A)。Cas12a RNP複合体を用いたゲノム編集技術では、Cas9ベースの手法に比べ、長めの欠損変異が入りやすいことが示されました。また、ゲノム上の離れた2カ所を切断することによる長い欠損変異導入や、Cas12a RNP複合体と一本鎖DNA(ssODN(一本鎖オリゴデオキシヌクレオチド)[9])を用いた短鎖DNA配列のノックイン(挿入)ができました。さらに、Cas12a RNP複合体とssODNを用いたDNA配列挿入により、ゲノム上の特定の塩基配列の正確な書き換えが可能であり(図2)、パラミロン合成酵素をコードする遺伝子の特定の塩基配列を書き換えることで、アミノ酸配列の置換によって酵素の機能の阻害を誘導しました。
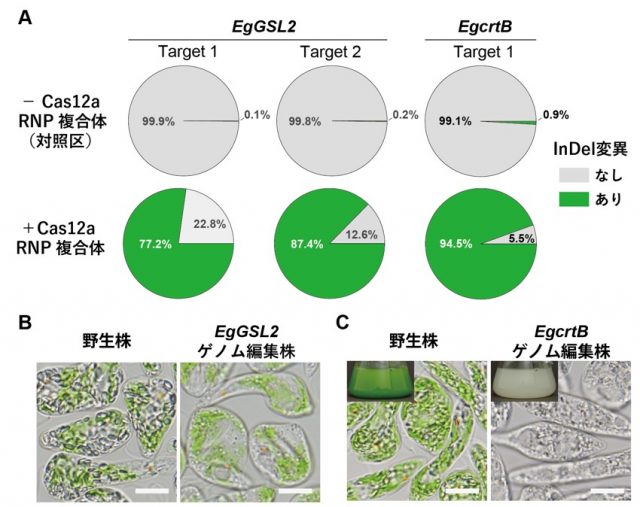
図1 Cas12a RNP複合体を用いたユーグレナのゲノム編集
(A)アンプリコンシークエンス解析による、Cas12a RNP複合体導入96時間後のユーグレナ細胞集団における各標的サイトへのInDel変異導入の効率。(B)Cas12a RNP複合体を用いて作成したEgGSL2遺伝子を標的としたゲノム編集株の表現型の例。ゲノム編集株には野生株に見られる細胞内の粒状のパラミロンの生産が見られない。スケールバーは10マイクロメートル(μm、1μmは100万分の1メートル)。(C)Cas12a RNP複合体を用いて作成したEgcrtB遺伝子を標的としたゲノム編集株の表現型の例。ゲノム編集株は白色化している。スケールバーは10μm。
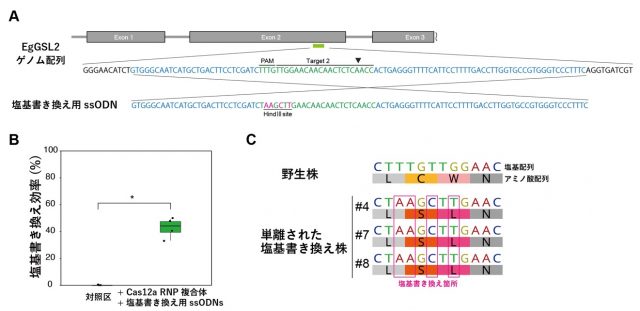
図2 ユーグレナにおける塩基書き換えの例
(A)塩基書き換えに用いたssODN配列と標的サイトの模式図。(B)Cas12a RNP複合体を用いた塩基書き換えの効率。(C)単離した塩基書き換え株におけるEgGSL2遺伝子塩基書き換え箇所の確認。
今後の期待
本研究によりCas12aを用いたゲノム編集が利用できるようになった結果、ユーグレナにおいて、Cas9では困難であったATリッチ領域を標的とするゲノムの編集ができるようになりました。さらに、精密な塩基書き換えによるタンパク質エンジリニアリングも可能となりました。これらは今後、本種における基礎研究の推進や有用株の分子育種に貢献することが期待されます。
本研究の成果は、国際連合が定めた17項目の「持続可能な開発目標(SDGs)」のうち「7.エネルギーをみんなにそしてクリーンに」と「13.気候変動に具体的な対策を」等への貢献が期待されます。
論文情報
<タイトル>
High-efficiency genome editing by Cas12a ribonucleoprotein complex in Euglena gracilis
<著者名>
Toshihisa Nomura, June-Silk Kim, Marumi Ishikawa, Kengo Suzuki, Keiichi Mochida
<雑誌>
Microbial Biotechnology
<DOI>
10.1111/1751-7915.14393
補足説明
[1] ユーグレナ・グラシリス(Euglena gracilis)
ユーグレナ属の微細藻類の一種で、水田や淡水の湖沼などに生育している。古くから生物学、生化学の実験材料に利用されてきた。屋内外での大量培養技術が確立されているため、多用途での利用が進められている。
[2] Cas12a RNP複合体、ATリッチ領域
クラス2タイプV型に分類されるCas12aヌクレアーゼと、標的配列を含むCRISPR RNA(crRNA)で構成されるリボ核タンパク質複合体。Cas12aヌクレアーゼの場合は、crRNAのみで活性のあるRNP複合体を形成できる。標的配列の認識に必要となるPAM配列はTTTV(VはA、C、Gのどれか)であるためATリッチ領域での標的配列が設計しやすい。DNAは5’突出末端の形で切断される。ATリッチ領域は、DNAを構成しA、T、G、Cの文字で表される4種類の塩基のうち、AとTに富むゲノム領域のこと。
[3] ゲノム編集技術
ヌクレアーゼ(核酸分解酵素)などのゲノム編集ツールを、配列部位特異的に作用させることで、ゲノムを改変する技術。
[4] 塩基書き換え
ゲノム上の特定箇所の塩基を書き換える遺伝子工学的な手法。
[5] 分子育種
対象とする生物のゲノムに関するDNAレベルの情報に基づいて、遺伝子組換えやゲノム編集などの技術を用いたゲノムの改変により、目的の形質を持つ個体を作出すること。
[6] 持続可能な開発目標(SDGs)
2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された、2016年から2030年までの国際目標。持続可能な世界を実現するための17のゴール、169のターゲットから構成され、発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる(外務省ホームページから一部改変して転載)。SDGsはSustainable Development Goalsの略。
[7] エレクトロポレーション法
電気パルスによって一時的に細胞膜に微小孔を開け、DNAや酵素タンパク質などを導入する細胞工学的な手法。
[8] アンプリコンシークエンス解析
細胞集団などにおけるゲノム上の特定の箇所の塩基配列を網羅的に解析するための手法。
[9] ssODN(一本鎖オリゴデオキシヌクレオチド)
ドナーDNAとしてRNP複合体と一緒に導入することで、相同性修復機構によるノックインや塩基書き換えができる。
共同研究グループ
理化学研究所
環境資源科学研究センター バイオ生産情報研究チーム
研究員(研究当時) 野村俊尚(ノムラ・トシヒサ)
(科技ハブ産連本部 バトンゾーン研究推進プログラム 藻類資源アップサイクル研究チーム 研究員(研究当時)、現 山形大学農学部 准教授、環境資源科学研究センター バイオ生産情報研究チーム 客員主管研究員)
研究員 キム・ジュンシク(June-Sik Kim)
チームリーダー 持田恵一(モチダ・ケイイチ)
(科技ハブ産連本部 バトンゾーン研究推進プログラム 藻類資源アップサイクル研究チーム 副チームリーダー )
科技ハブ産連本部 バトンゾーン研究推進プログラム 微細藻類生産制御技術研究チーム
テクニカルスタッフⅡ(研究当時) 石川まるみ(イシカワ・マルミ)
(現 藻類資源アップサイクル研究チーム 客員研究員、株式会社ユーグレナ)
科技ハブ産連本部 バトンゾーン研究推進プログラム 藻類資源アップサイクル研究チーム
チームリーダー 鈴木健吾(スズキ・ケンゴ)
(株式会社ユーグレナ エグゼクティブフェロー)
研究支援
本研究は日本学術振興会(JSPS)科学研究費助成事業基盤研究(C)「応用利用に向けたユーグレナにおけるパラミロン粒形態制御の分子機構解明(研究代表者:野村俊尚、21K05511)」、科学技術振興機構(JST)OPERA機能性バイオ共創コンソーシアム(領域統括:三谷啓志(東京大学))、JST/JICA SATREPS「微細藻類による二酸化炭素の固定と資源化によるエネルギーおよび食料資源の持続的生産システムの創出(研究代表者:持田恵一、JPMJSA2204)」による助成を受けて行われました。
※2024年2月2日追記 論文掲載情報について訂正しました
※2024年2月14日更新 論文情報について更新しました
― 本件に関するお問い合わせ先 ―
理化学研究所 広報室 報道担当
株式会社ユーグレナ 広報宣伝部
